
Вода - субстанция жизни
Многочисленные научные данные свидетельствуют о том, что жизнь
зародилась в водной среде [1]. За последние десятилетия, используя
разные источники энергии, в лабораторных условиях из неорганических
веществ были синтезированы самые разнообразные органические соединения –
аминокислоты, протеины, нуклеозиды и др. [2]. В этих опытах
моделировались условия первичной бескислородной атмосферы, в которой был
возможен синтез органических молекул из неорганических за счет энергии
коротковолнового ультрафиолетового излучения Солнца, энергии
электрических разрядов и других геотермальных источников энергии [3]. Первые
эксперименты по неорганическому синтезу органических веществ в условиях
первичной бескислородной атмосферы, были проведены в 1959 году
американским ученым С. Миллером [4]. Смесь воды и газов – водорода (Н2), метана (CH4), аммиака (NH3)
и монооксида углерода (CO), находящаяся в замкнутом сообщающемся
сосуде, подвергалась воздействию электрических разрядов при температуре
кипения воды. В ходе реакции из исходных неорганических веществ
синтезировались органические соединения – альдегиды и аминокислоты.
Опыты обнаружили, что 10—15 % углерода перешло в органическую форму.
Около 2 % углерода детектировалось в виде аминокислот, самым
распространённым из которых оказался глицин. Первичный анализ показал
наличие в реакционной смеси 5 аминокислот. Однако, более полный
повторный анализ, проведеный в 2008 году, показал образование в
реакционной смеси 22 аминокислот, содержащих от 5 до 20 атомов в
молекуле (рис. 1) [5]. Наряду с аминокислотами в реакционной смеси также
были обнаружены сахара, липиды и предшественники нуклеиновых кислот -
нуклеозиды. 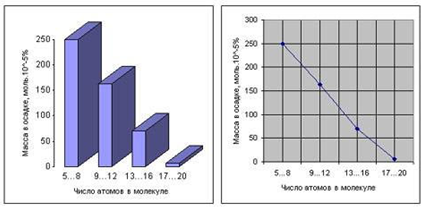
Рис. 1.
Распределение соединений, полученных в экспериментах Миллера, по массе и
числу атомов углерода в молекуле (диаграммы построены по данным С.
Миллера [4, 5])
Эксперименты Миллера вызвали
большой интерес среди учёных всего мира. К аналогичным опытам
приступили другие исследователи. В 1960 году Уилсон [6] при обработке
искровым разрядом паров воды (Н2О), аммиака (NH3), сероводорода (H2S),
серы и золы дрожжей, получил более крупные молекулы органических
полимеров, содержащих 20 и более атомов углерода. Эти полимеры в водной
среде формировали тонкие пленки, с площадью поверхности около 1 см2,
представляющие собой поверхностно-активные вещества, сконцентрированные
на поверхности раздела вода - воздух (рис. 2). Предполагается, что эти
пленки молекул полимеров, синтезировавшихся на границе между разными
фазами, играли важную роль на ранних стадиях эволюции первых
организованных мембраноподобных структур. Катализатором их образования
могла служить сера и ее производные, которые были широко распространены
на первобытной Земле в форме зерен сульфидов, встречающихся, например, в
пиритовых песках. 
Рис. 2. Тонкие плёнки органических полимеров, образующихся при искровых разрядах в смеси паров воды (Н2О), аммиака (NH3), сероводорода (H2S), серы и золы дрожжей [6].
В
1969 году Поннамперума и сотр. провели эксперименты, аналогичные
экспериментам Миллера, используя в качестве источника энергии
ультрафиолетовое излучение [7]. Хотя по теоретическим соображениям
синтезы, идущие под воздействием ультрафиолетового излучения, не должны
принципиально отличаться от тех, которые индуцируются электрическим
разрядом, было важно получить экспериментальное подтверждение этого
факта, поскольку в условиях первичной атмосферы гораздо больше энергии
поступало с ультрафиолетовым излучением. Как ожидалось, исследователи не
только смогли синтезировать аминокислоты и пурины, т. е. строительные
блоки белков и нуклеиновых кислот, но также смогли синтезировать из этих
блоков полимеры [8]. Аминокислоты полимеризовались в пептидные цепи в
присутствии катализатора – цианистого водорода – HCN. При дальнейшей
обработке реакционной смеси фосфорной кислотой (Н3РО4) в водной среде синтезировались нуклеотиды. Предполагается,
что в условиях восстановительной атмосферы небольшие органические
молекулы могли синтезироваться за счет энергии ультрафиолетового
излучения Солнца. Однако условия на Земле в эпоху бескислородной
атмосферы для первых органических систем были довольно жёсткими. Хотя
первые организмы в бескислородной атмосфере не подвергалась окислению,
ничто не защищало их от губительного воздействия жесткого
ультрафиолетового излучения. Поэтому необходимо учитывать, что для
синтеза органических молекул могли использовались другие истчники
энергии. За счет высокоэнергетического ультрафиолетового излучения
Солнца могли синтезироваться малые органические молекулы и свободные
радикалы. Для синтеза из малых молекул других, более сложных соединений
могли использоваться геотермальные источники энергии. Так, в растворах
формальдегида с гидроксиламином, формальдегида с гидразином и в
растворах, содержащих цианистый водород, после нагрева реакционной смеси
в конце опыта обнаруживались аминокислоты [9]. В других экспериментах
эти продукты полимеризовались в пептидные цепи, что является важным
этапом на пути к неорганическому синтезу белка. В реакционной смеси с
раствором цианистого водорода (HCN) в водном аммиаке (NH3)
также образовывались более сложные соединения, входящие в состав
нуклеиновых кислот – азотистые основания пурины и пиримидины,
изображенные на рис. 3 [10]. 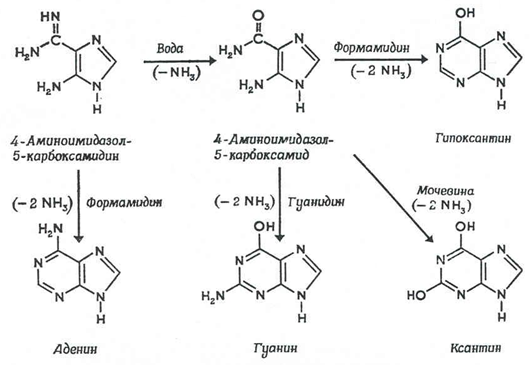 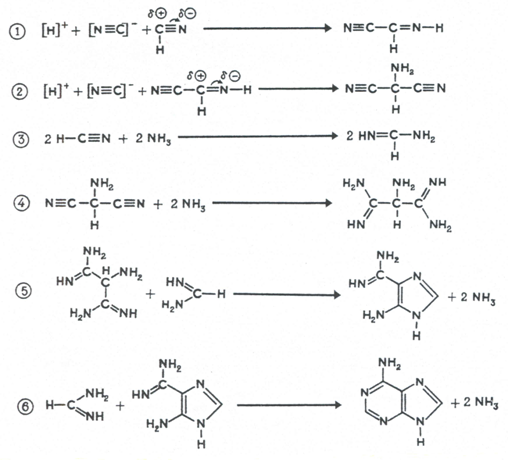
Рис. 3.
Предполагаемые механизмы образования пуринов – аденина, гуанина и
ксантина из водной смеси аммиака и цианистого водорода (вверху) и
аденина из водной смеси аммиака и цианистого водорода (внизу).
(суммарная реакция: 5HCN = аденин) [10]. Промежуточные продукты синтеза –
4-аминоимидазол-5-карбоксамидин и 4-аминоимидазол-5-карбоксамин
детектировались в растворе.
Полученные
результаты продемонстрировали возможный путь перехода от синтеза малых
органических молекул за счет энергии ультрафиолетового излучения Солнца к
более сложным органическим молекулам, образующимся при менее жестких
термических воздействиях. Это очень важно для формирования представлений
о ранней эволюции первых форм жизни. Важную роль в этом процессе играли
молекулы жизненно-важных соединений – протеинов и нуклеиновых кислот.
Как известно, молекулы протеинов построены из одной или нескольких
полипептидных цепей, состоящие из большого числа различных аминокислот.
Их последующая конденсация в полипептидные цепи может произойти в
определённых условиях, после их образования. Важным фактором в реакции
конденсации двух молекул аминокислот является выделение молекулы воды.
Поскольку реакция поликонденсации аминокислот сопровождается
дегидратацией, при удалении воды из системы скорость реакции
увеличивается. Этот факт свидетельствует о том, что раннее развитие
жизни происходило вблизи действующих вулканов, поскольку в ранние
периоды геологической истории вулканическая деятельность происходила
более активно, чем в последующие геологические времена. Однако
дегидратация сопровождает не только полимеризацию аминокислот, но и
объединение других блоков в более крупные органические молекулы, а также
полимеризацию нуклеотидов в нуклеиновой кислоты. Такое объединение
всегда связано с реакцией конденсации, при которой от одного блока
"отщепляется" протон Н+, а от другого - гидроксильная группа ОН- с образованием молекулы воды (Н2О)[11]. Первым
возможность существования реакций конденсации-дегидратации в условиях
первичной гидросферы доказал Кальвин в 1965 году [12]. Из всех
соединений только синильная кислота (HCN) и ее произодные - цианамид
(HNCN2) и дицианамид HN(C = N)2 обладают
дегидратирующей способностью и способностью катализировать процесс
связывания молекулы воды первичной гидросферы [13]. На присутствие
синильной кислоты в первичной гидросфере указывают и ранние эксперименты
Миллера. Химические реакции с синильной кислотой и ее производными
сложны, их механизм окончательно не выяснен. Как показано на рис. 4, в
присутствии синильной кислоты и цианамидов конденсация отдельных блоков,
сопровождаемая дегидратацией, может идти при нормальных температурах в
сильно разбавленных водных растворах.
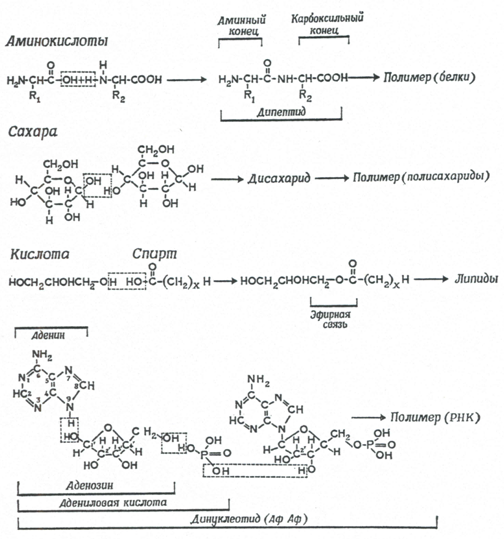
Рис. 4.
Реакции конденсации и дегидратации, приводящие к образованию из
отдельных молекул более крупных органических молекул. Верхние три
уравнения: конденсация и последующая полимеризация аминокислот в
протеины, сахаров в полисахариды и кислот и спиртов в липиды. Нижнее
уравнение - конденсация аденина с рибозой и фосфорной кислотой,
приводящая к образованию нуклеотида [12].
Реакции
поликонденсации аминокислот в присутствии синильной кислоты и ее
производных зависят от кислотности водных растворов, в которых они
протекают [14]. В кислых водных средах (рН 4-6) эти реакции не идут,
тогда как щелочные условия (рН 8-9) способствуют их протеканию. До сих
пор не существует однозначного мнения, имел ли первичный океан щелочной
состав, но вероятно, что именно таким значением рН обладала озерная
вода, соприкасавшаяся с базальтом, и эти реакции могли происходить при
контакте воды с базальтовыми породами. В модельных условиях первичной гидросферы безводную смесь аминокислот подвергали воздействию температур от 600С до 1700С
с образованием коротких протеинов. При этом наилучшие результаты по
поликонденсации получались со смесями аминокислот, содержащими
аспарагиновую и глутаминовую кислоты [15]. Эти аминокислоты относятся к
числу незаменимых аминокислот, встречающихся во всех современных
организмах. В процессе синтеза из них образовывались соединения сходные с
природными белками, впоследствии названные протеиноидами. Они состояли
из крупных молекул с молекулярной массой до 300000, состоящих из тех же
аминокислот, что и природные белки. По количественному составу они
содержат 18 из 22 аминокислот, обычно встречающихся у современных
организмов, что сооответствует общему определению белка. С природным
белком протеиноиды сходны и по ряду других важных свойств, например по
связыванию полинуклеотидов, по пригодности в пищу бактериям и крысам, по
способности вызывать реакции, сходные с теми, которые катализируются
ферментами в живых организмах. Так, эти искусственно синтезированные
органические соединения способны каталитически разлагать глюкозу [16] и
оказывать действие аналогичное действию меланоцитстимулирующего гормона
[17]. Другим важным свойством протеиноидных соединений является
их гетерогенность. Это означает, что последовательность аминокислот в их
пептидных цепях не случайна, а, напротив, закономерна. Но в то время
было невозможно провести точное сравнение этих искусственных соединений с
природными белками, так как молекулы белков настолько сложны, что
структура многих из них еще не определена с достаточной точностью. Чтобы
подчеркнуть сходство этих искусственных белковоподобных соединений с
природными белками, они были названы протеиноидами [18]. Поскольку они
были синтезированы под действием тепла, в дальнейшем их стали обозначать
"термическими протеиноидами". За последние годы много было
сделано для изучения структуры и свойств протеиноидов. Если промыть
горячую смесь протеиноидов водой или водными растворами солей, в водной
среде образуются элементарные мембраноподобные микросферы [19]. Размер
микросфер очень мал, их диаметр составляет около 2 мкм. По
морфологическим особенностям микросферы напоминают мембрану клетки (рис.
5). 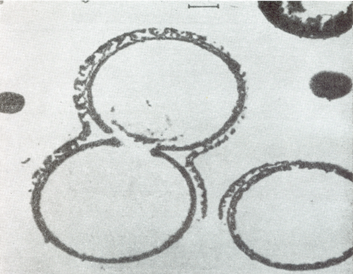 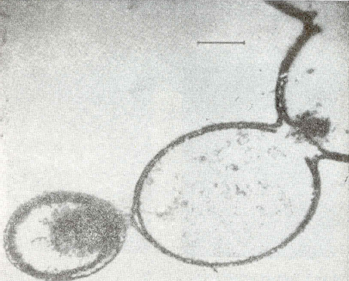
Рис. 5. Электронные микрофотографии протеноидных микросфер в водной среде [19].
Как
показали исследования протеноидные микросферы довольно стабильны. При
помещении их в водные растворы другой концентрации, чем концентрация
исходного раствора, в котором они образовались, они начинают реагировать
на внешние условия. В концентрированных водных растворах они
сморщиваются, в разбавленных набухают, т. е. их реакция на изменение
осмотического давления сходна с реакцией живых клеток. Это объясняется
наличием у них полупроницаемой наружной оболочки, сходной с мембраной
клетки, которая может быть также и двойной. Образование
протеноидных микросфер из смеси искусственных протеинов важно поскольку
дает материал для суждения о том, как мог произойти следующий этап
эволюции жизни. Это этап от разрозненных органических молекул к группам
организованных молекул - коацерватам, собранным в отдельные структуры и
отделенными от окружающего мира примитивной мембраной – аналогом
мембраны клетки, что было впервые продемонстрировано нашим
соотечественником академиком А. И. Опариным [20]. С учётом
вышеназванных факторов происхождение жизни выглядит следующим образом.
Начальным этапом эволюции, по-видимому, было образование в первичной
гидросфере и насышенной водяными парами атмосфере при высоких
температурах аминокислот и азотистых соединений – аналогов нуклеиновых
кислот. Такой синтез возможен при наличии в водной среде фосфорной
кислоты и воздействии электрических разрядов, ультрафиолетового
излучения и высоких температур [21]. Следующий этап - поликонденсация
аминокислот в протеиноиды при температурах 65-1700С. Реакция
поликонденсации происходит в присутствии фосфатов, если в водной смеси
имеется достаточные количества аспарагиновой и глутаминовой кислот.
Затем в смеси протеиноидов при воздействии на них водой или кислыми
водными растворами (дождем) образуются коарцерваты – предшественники
первых клеток, обладающие каталитической активностью. Способность
протеиноидов к выполнению некоторых функций, сходных с функциями
ферментов живых организмов, выражается в том, что они могут в
присутствии гидрата окиси цинка расщеплять АТФ, т. е. обладают слабой
ферментативной активностью. Впоследствие этого у микросфер в дальнейшем
могла появиться способность к синтезу РНК, которые могли случайным
образом кодировать короткие белки. Важную роль в происхождении жизни, по-видимому, играл самый распространённый минерал земной коры кварц SiO2.
Кристалл кварца обладает тетраэдрической структурой, из которой могут
складываются различные цепочечные и ленточные переплетающиеся друг с
другом силикатные структуры. Уникальность кварца заключается в том, что
его кристаллы оптически активны, т. е. способны взаимодействовать с
поляризованным светом. Но кристаллы кварца не просто воздействуют на
проходящий через них свет, они также обладают оптически активными
свойствами на поверхности кристалла. Поэтому, на поверхности L- и D-
энантиомерных кристаллов кварцев была возможна избирательная абсорбция
L- и D-изомеров, что может объяснить стереоселективность эволюции. Другим
интересным свойством кварца является то, что его структура удивительным
образом напоминает структуру самой воды (рис. 6). Еще первооткрыватели
водородных связей Дж. Бернал и Р. Фаулер в 1932 г. сравнивали структуру
жидкой воды с кристаллической структурой кварца, а ассоциаты воды
рассматривались как тетрамеры 4Н20, в которых четыре молекулы
воды соединены в тетраэдр с двенадцатью внутренними водородными
связями, в результате образуется четырёхгранная пирамида – тетраэдр
[22]. 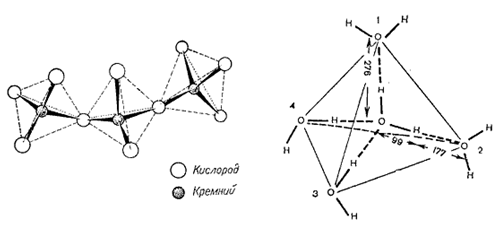
Рис. 6. Кристаллическая структура кварца (слева) и тетраэдрическая структура воды (справа).
По
мнению российского исследователя Колясникова [23] водородные связи в
водных тетрамерах могут образовывать как право- так и левовинтовую
последовательности, аналогично тому, как кристаллы кварца существуют в
право- и лево-вращательной кристаллической формах. Так как каждый такой
тетрамер воды имеет еще и четыре незадействованные внешние водородные
связи, то тетрамеры могут соединяться этими внешними связями в своего
рода полимерные цепочки, наподобие молекулы ДНК (рис. 7-10). Поскольку
внешних связей всего четыре, а внутренних - в три раза больше, то это
позволяет тетрамерам в жидкой воде изгибать, поворачивать и даже
надламывать эти ослабленные тепловыми колебаниями молекул воды внешние
водородные связи. Согласно этому предположению это и обуславливает
текучесть воды. 
Рис. 7. Элементарные кремнекислородные единицы-ортогруппы SiO44- в структуре Mg-пироксена в минерале энстатите (а) и диортогруппы Si2O76- в Са-пироксеноиде волластоните (б).
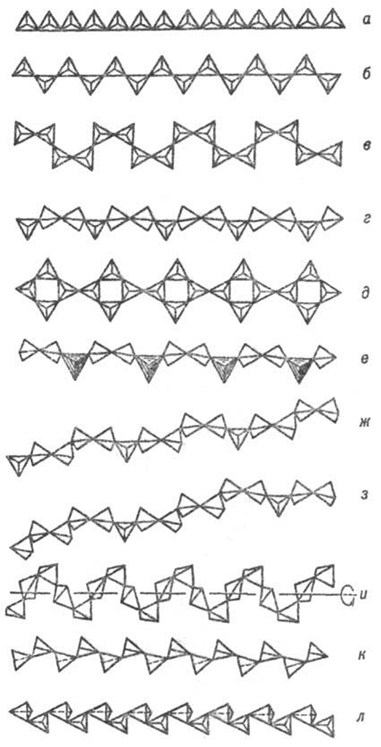
Рис. 8.
Основные типы кремнекислородных цепочечных группировок (по Белову):
а-метагерманатная, б - пироксеновая, в - батиситовая, г-волластонитовая,
д-власовитовая, е-мелилитовая, ж-родонитовая, з-пироксмангитовая,
и-метафосфатная, к-фторобериллатная, л - барилитовая.
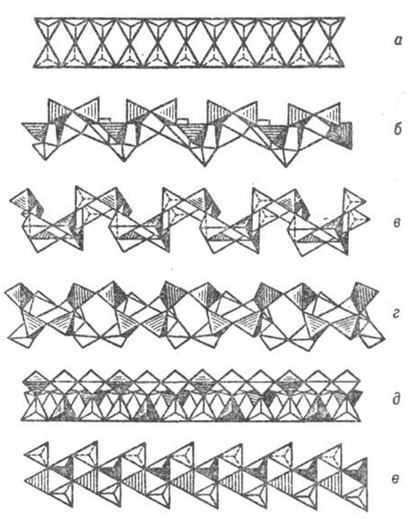
Рис. 9.
Основные типы ленточных кремнекислородных группировок (по Белову): а -
силлиманитовая, амфиболовая, ксонотлитовая; б-эпидидимитовая;
в-ортоклазовая; г-нарсарсукитовая; д-фенакитовая призматическая;
е-эвклазовая инкрустированная.
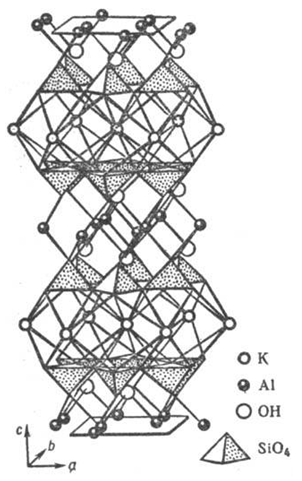
Рис. 10. Фрагмент слоистой кристаллической структуры минерала мусковита KAl2(AlSi3O10.OH)2, иллюстрирующий переслаивание алюмокремне-кислородных сеток с полиэдрическими слоями крупных катионов Al3+ и K+, напоминающие двухцепочечную структуру ДНК.
|











